خاموشسازی ژن برای بیماری هانتینگتون: داستان تا به امروز
آیا خاموشسازی ژن به همان اندازه که برای بیماری هانتینگتون هیجانانگیز به نظر میرسد، هست و آینده چه چیزی در انتظار دارد؟

خاموشسازی ژن به معنای استفاده از مولکولهای ویژهای است که پیام تولید پروتئین هانتینگتین مضر توسط سلولها را «خاموش» میکنند. آغازگر خاموشسازی ژن HDBuzz ما، تکنیکها، نتایج تا به امروز و چالشهای پیش رو را توضیح میدهد.
درخواستهای زیادی از خوانندگان برای نوشتن مقالهای در مورد «خاموشسازی ژن» – که به عنوان «خاموشسازی هانتینگتین» نیز شناخته میشود – داشتهایم. این یک حوزه تحقیقاتی است که هیجان زیادی ایجاد میکند. توجه بسیاری از مردم به این موضوع با انتشار مطبوعاتی مشترک اخیر از لوندبک و دانشگاه ماساچوست جلب شده است که از همکاری تحقیقاتی با هدف توسعه درمانهای «مداخله RNA (RNAi)» برای بیماری هانتینگتون خبر میدهند.
بنابراین، خاموشسازی ژن چیست؟ چگونه کار میکند و چگونه ممکن است برای بیماران مبتلا به بیماری هانتینگتون مفید باشد؟

ژنها، پیامها و پروتئینها
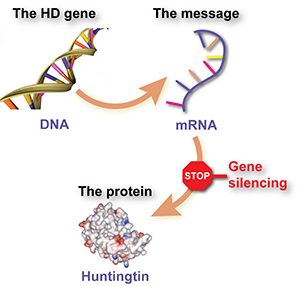
پروتئینها مولکولهایی هستند که مانند ماشینهای کوچک عمل میکنند و بیشتر کارهای مفید داخل سلولها را انجام میدهند – کارهایی مانند انجام واکنشهای شیمیایی، انتقال پیامها، دادن ساختار به سلولها و غیره. هر پروتئین مختلف با استفاده از مجموعهای از دستورالعملها به نام ژن ساخته میشود. ژنها از DNA ساخته شدهاند و در مرکز کنترل سلول، هسته، زندگی میکنند.
البته ژنها به طور مستقیم برای ساخت پروتئینها استفاده نمیشوند. در این بین، سلول از توالی DNA ژن به عنوان الگو برای ساخت یک «مولکول پیامرسان» به نام «RNA پیامرسان» یا mRNA استفاده میکند. سپس از مولکول پیامرسان mRNA برای گفتن به سلول استفاده میشود که چه بلوکهای ساختمانی را به هم بچسباند تا پروتئین ساخته شود.
به طور خلاصه، DNA به عنوان الگو برای ساخت پیام mRNA استفاده میشود و سپس از مولکول پیامرسان برای ساخت مولکولهای پروتئینی استفاده میشود.
بیماری هانتینگتون ناشی از یک ژن غیرطبیعی است – ژنی که به سلولها میگوید پروتئینی به نام هانتینگتین تولید کنند. هر سلول دو نسخه از هر ژن دارد. بیشتر افراد مبتلا به بیماری هانتینگتون، یا کسانی که بعداً به آن مبتلا میشوند، یک ژن «طبیعی» و یک ژن با تکرارهای بیش از حد توالی سهحرفی «CAG» در نزدیکی ابتدا دارند. این «اشتباه املایی» ساده منجر به یک پروتئین «جهشیافته» میشود که متفاوت از پروتئین طبیعی عمل میکند، به سلولها آسیب میرساند و علائم بیماری هانتینگتون را ایجاد میکند.
شاید اصطلاح «نوع وحشی» را شنیده باشید – این چیزی است که دانشمندان ژن و پروتئین غیرجهشیافته یا «طبیعی» مینامند.
خاموشسازی ژن هانتینگتین
از آنجایی که ژن غیرطبیعی علت همه مشکلات در بیماری هانتینگتون است، چرا فقط از شر آن خلاص نشویم و آن را با یک ژن سالم جایگزین نکنیم؟ متأسفانه، این احتمالاً کارساز نخواهد بود، زیرا سلولها راههای بسیار ایمنی برای محافظت از DNA برای جلوگیری از آسیب یا تغییرات دارند.
از طرف دیگر، مولکول پیامرسان mRNA در سلول شناور است و تا زمانی که وجود داشته باشد، به طور مداوم برای ساخت مولکولهای پروتئینی بیشتر استفاده میشود. اگر بتوانیم به نحوی به سلول بگوییم که آن پیام را نادیده بگیرد، پروتئین مضر ساخته نمیشود. این تفکر پشت «
به نظر میرسد خاموشسازی ژن خیلی خوب است که درست باشد، اما اینطور نیست. در سال 1998، دو محقق که برنده جایزه نوبل پزشکی شدند، نحوه خاموش کردن ژنهای منفرد را کشف کردند. آنها تکنیک خود را مداخله RNA (RNAi) نامیدند.
خاموشسازی ژن اکنون یک تکنیک استاندارد است که توسط دانشمندان برای مطالعه نحوه عملکرد موجودات زنده، نحوه ایجاد آسیب توسط بیماریها و به عنوان راهی برای توسعه درمانها استفاده میشود. یک داروی خاموشسازی ژن (Vitravene، مورد استفاده برای درمان عفونت ویروسی چشم) برای استفاده انسانی مجوز دارد و بیش از دوازده آزمایش در حال انجام در بسیاری از بیماریهای مختلف وجود دارد و موارد بیشتری نیز در راه است.
اگر به همین راحتی بود، ما در حال حاضر قرصهای خاموشسازی ژن برای بیماری هانتینگتون داشتیم، پس مشکل کجاست؟ خوب، مانند هر تکنیک جدیدی، چالشها، شکستها و موانع غیرمنتظرهای در طول مسیر وجود خواهد داشت.
چالش اول: ورود به مغز
یکی از مشکلات عمده، رساندن مولکولهای خاموشکننده به جایی است که به آنها نیاز است. در بیماری هانتینگتون، مرگ سلولهای مغزی به نام نورونها مسئله اصلی است، بنابراین باید مولکول را وارد آن سلولها کنیم.
“چندین گروه مختلف از محققان اکنون موفقیت در کاهش تولید هانتینگتین در مدلهای حیوانی را گزارش کردهاند”
اولین مانع، وارد کردن دارو به مغز است. مغز دارای یک سپر دفاعی طبیعی است تا از ورود مواد مضر از خون به آن جلوگیری کند. این به طور کلی برای ما خوب است، زیرا از مغز محافظت میکند، اما برای محققان داروی بیماری هانتینگتون سردرد ایجاد میکند، زیرا وارد کردن داروها به مغز را بسیار سختتر از ورود به، مثلاً، کبد یا کلیهها میکند.
بنابراین بعید است که یک قرص یا تزریق ساده برای مبارزه با بیماری هانتینگتون با خاموشسازی ژن مناسب باشد. یک راه حل برای این مشکل استفاده از پمپها و لولههای کوچک برای تزریق مستقیم داروی خاموشکننده به مغز یا مایعی است که آن را احاطه کرده است – مایع مغزی نخاعی یا CSF. این بسیار دلهرهآور به نظر میرسد و شکی نیست که کاشت پمپها یا لولهها در سیستم عصبی یک مسئله بزرگ است، اما در واقع سیستمهای مشابهی در حال حاضر برای رساندن داروها در سایر بیماریها مانند مولتیپل اسکلروزیس (MS) و سرطان مغز استفاده میشوند، جایی که سابقه ایمنی بسیار خوبی دارند.
چالش دوم: توزیع
هنگامی که دارو وارد سیستم عصبی شد، مشکل توزیع هنوز حل نشده است. مغز یک توپ متراکم از بافت است که مولکولهای خاموشکننده به سختی میتوانند از طریق آن پخش شوند. علاوه بر این، درمان باید برای کار کردن وارد سلولها شود – شناور شدن در بین سلولها کافی نیست.
دانشمندان از روشهای مختلفی برای حل این مشکل استفاده میکنند. برندگان جایزه نوبل از مولکولهای مداخله RNA (RNAi) برای خاموش کردن ژنها استفاده کردند. اینها بسیار شبیه به مولکولهایی هستند که به طور طبیعی توسط سلولها تولید میشوند. عیب این است که آنها تمایل ندارند به طور طبیعی در مغز پخش شوند و در وارد شدن به سلولها چندان خوب نیستند.
بنابراین، محققان RNAi تمایل دارند از لولههای بسیار ظریفی استفاده کنند که در ماده مغز وارد میشوند و مناطق بدتر را هدف قرار میدهند، و به پمپهایی متصل میشوند که از فشار برای پخش بیشتر دارو استفاده میکنند. گزینه دیگر این است که به مولکولهای RNAi اجازه دهیم «سوار شوند» در داخل ویروسهای غیرفعال شده، که متخصص در پخش شدن در اطراف مغز و تزریق مواد به داخل سلولها هستند.
رویکرد دیگر تلاش برای مولکولهای مختلفی است که ممکن است در پخش شدن در اطراف و وارد شدن به سلولها بهتر باشند. الیگونوکلئوتیدهای آنتیسنس (ASOها) شبیه به مولکولهای RNAi هستند اما کمی سادهتر هستند و به طور طبیعی توسط سلولها تولید نمیشوند. اصل همان است – آنها به مولکول پیامرسان mRNA میچسبند و از استفاده سلول از آن برای ساخت پروتئینها جلوگیری میکنند.
به نظر میرسد ASOها در پخش شدن در سراسر مغز بسیار بهتر هستند و میتوانند به راحتی وارد سلولها شوند. به نظر میرسد که آنها همچنین بسیار طولانیتر دوام میآورند – که بسته به اینکه چقدر خوب کار خود را انجام میدهند، میتواند چیز خوبی یا بدی باشد.
کدام تکنیک خاموشسازی ژن بهتر است؟ ما فقط نمیدانیم، بنابراین RNAi و ASOها به طور همزمان روی آنها کار میشود تا ببینیم کدام یک بهترین است.
چالش سوم: خاموش کردن ژن
آزمون کلیدی یک درمان خاموشسازی ژن این است که آیا میتواند ژن را با موفقیت خاموش کند یا خیر. تاکنون، تحقیقات در مدلهای حیوانی بیماری هانتینگتون به شدت نشان داده است که این امر با درمانهای RNAi و ASO قابل دستیابی است.
در سال 2005، تیمی از محققان به رهبری Bev Davidson در آیووا، مولکولهای RNAi را به مغز موشهای مبتلا به بیماری هانتینگتون تزریق کردند و به 85٪ کاهش در پیام هانتینگتین دست یافتند. عملکرد حرکتی و ناهنجاریهای سلولی موشها نیز بهبود یافت. از آن زمان، چندین گروه مختلف از محققان موفقیت در کاهش تولید هانتینگتین با استفاده از مولکولهای مختلف، از جمله داروهای RNAi و ASO را گزارش کردهاند. جدیدترین کار نشان میدهد که مزایای حتی تزریقهای کوتاه مدت برای مدت طولانی حفظ میشود.
چالش چهارم: انتخاب هدف مناسب
محققان دارو دوست دارند مشکلات را از قبل شناسایی کنند تا اینکه منتظر بمانند تا اتفاق بیفتند، و یک مشکل احتمالی در خاموشسازی ژن، اثرات آن بر روی نسخه طبیعی یا نوع وحشی ژن هانتینگتین است.
ما میدانیم که نداشتن هیچ هانتینگتینی خطرناک است. موشهایی که هیچ نسخهای از ژن ندارند، قبل از تولد میمیرند. بنابراین سوال کلیدی این است که آیا کاهش هانتینگتین جهشیافته که برای درمان بیماری مورد نیاز است، باعث کاهش هانتینگتین نوع وحشی میشود که خطرناک است؟
در حال حاضر ما نمیدانیم. برخی از محققان احساس میکنند که فقط کاهشهای کوچک در هانتینگتین جهشیافته برای دادن فرصت به سلولها برای بهبودی کافی خواهد بود، بنابراین نیازی نیست نگران اثرات مضر کاهش اندک پروتئین نوع وحشی باشیم. دیگران معتقدند که ما باید درمانهایی را توسعه دهیم که فقط پروتئین جهشیافته را خاموش کنند. این خاموشسازی ویژه الل نامیده میشود – الل چیزی است که ما هر یک از دو نسخه یک ژن را مینامیم.
به نظر میرسد خاموشسازی ویژه الل بسیار منطقی است – اگر بتوانیم ژن جهشیافته را هدف قرار دهیم، چرا این کار را نکنیم؟ نکته منفی این است که برای هدف قرار دادن فقط یک نسخه از یک ژن، باید DNA هر بیمار را برای تفاوتهای «املایی» فردی بین دو الل بررسی کنید. خوشبختانه، چنین تفاوتهایی رایج هستند، اما ما احتمالاً به چندین داروی مختلف نیاز داریم تا بتوانیم درمان هدفمند را برای هر چه بیشتر بیماران ارائه دهیم. برخی از بیماران هیچ تفاوت املایی مناسبی ندارند که بتوان به این شکل هدف قرار داد.
بحث در مورد اینکه آیا خاموشسازی ویژه الل ضروری است یا خیر، ادامه دارد، اما خبر خوب این است که ما مجبور نخواهیم بود مدت بیشتری برای پاسخ صبر کنیم، زیرا هر دو تکنیک در حال حاضر توسط گروههای مختلف محققان آزمایش میشوند.
چالش پنجم: عوارض جانبی
درمانهای خاموشسازی ژن ممکن است همچنان عوارض جانبی داشته باشند، حتی اگر از مشکلات احتمالی کاهش هانتینگتین نوع وحشی جلوگیری شود.
یک مشکل، به اصطلاح «اثرات خارج از هدف» است، جایی که مولکول دارو به مولکولهای پیامرسان برای ژنهای دیگر غیر از هانتینگتین میچسبد و در آنها تداخل ایجاد میکند. این میتواند هر تعداد مشکلی ایجاد کند.
مسئله دیگر این است که سیستم ایمنی مغز ممکن است در نهایت با مولکولهای «بیگانه» که به آن پمپ میشوند، مبارزه کند و این میتواند اوضاع را بدتر کند.
ما باید این عوارض جانبی احتمالی را جدی بگیریم، در حالی که هنوز در مرحله آزمایش آنها در حیوانات هستیم. حتی اثرات ناخواسته نسبتاً خفیف میتواند خبر بدی باشد، به خصوص اگر خاموشسازی ژن در نهایت برای سالهای متمادی برای جلوگیری از علائم در افرادی که آزمایش مثبت داشتهاند استفاده شود.
دانشمندان در تلاشند تا بهترین مولکولها را با کمترین خطر عوارض جانبی جدی تولید کنند و فقط ایمنترین آنها برای آزمایشهای انسانی ارائه میشوند.
کی، کی، کی؟
هیجان در مورد خاموشسازی ژن موجه است، زیرا بسیاری از محققان احساس میکنند که این بهترین شانس ما برای تولید درمانهای موفقیتآمیز بیماری هانتینگتون است. واضح است که مسائل زیادی برای حل و فصل وجود دارد، اما با گذشت هر سال پیشرفتهایی حاصل میشود و همه موافق هستند که تاکنون هیچ چیزی یافت نشده است که نشان دهد این تکنیک در بیماران کارساز نخواهد بود.
در حال حاضر یک آزمایش خاموشسازی ژن ASO در بیماران مبتلا به ALS (بیماری نورون حرکتی) در حال انجام است. این واقعاً مهم است زیرا نه تنها دارو، بلکه سیستم تحویل پمپ و لوله را نیز برای رساندن دارو به جایی که مورد نیاز است آزمایش میکند. در همین حال، بسیاری از محققان در سراسر جهان در حال بررسی این موضوع هستند که کدام مولکولها برای آزمایش در بیماران مبتلا به بیماری هانتینگتون بهترین خواهند بود.
ما نمیتوانیم با اطمینان بگوییم که چه زمانی درمانهای خاموشسازی ژن برای بیماران در دسترس خواهد بود، اما HDBuzz ناامید خواهد شد اگر آزمایشهای خاموشسازی ژن بیماری هانتینگتون انسانی را در آینده بسیار نزدیک نبینیم.
بیشتر بدانید
برای اطلاعات بیشتر در مورد سیاست افشای اطلاعات ما، به سوالات متداول مراجعه کنید…