
غربالگری کل ژنوم برای یافتن اهداف دارویی جدید برای بیماری HD
دانشمندان کل ژنوم را غربال میکنند تا اهداف درمانی بالقوه جدیدی برای بیماری HD پیدا کنند. این مطالعه جاهطلبانه، دادههای فراوانی را برای محققان HD فراهم میکند.

مطالعهای که اخیراً در مجله «Neuron» منتشر شده است، اهداف درمانی بالقوه جدیدی را برای درمان بیماری هانتینگتون (HD) شناسایی کرده است. این کار که توسط پروفسور میریام هایمن و همکارانش انجام شده است، از فناوریهای ژنتیکی پیشرفته استفاده کرده و چندین ژن را کشف کرده است که میتوانند پیشرفت HD را در مدلهای آزمایشگاهی خود تغییر دهند. بسیاری از این ژنها قبلاً به HD مرتبط نبودهاند و میتوانند اهداف جدید و هیجانانگیزی برای محققان در هنگام تولید داروها و درمانها برای جامعه بیماران HD باشند.
غربالگری جاهطلبانه کل ژنوم
سلولهای بدن ما حاوی DNA هستند که هزاران ژن را رمزگذاری میکند، که هر کدام دستورالعملی برای سلولهای ما هستند که چگونه یک مولکول پروتئینی متفاوت بسازند. این دستورالعملها از DNA ما به پیامی به نام RNA پیامرسان رونویسی میشوند. سپس RNA توسط ماشینآلات سلولی به مولکولهای پروتئینی ترجمه میشود. دانشمندان میتوانند این فرآیندها را در آزمایشگاه دستکاری کنند تا نقش ژنهای مختلف را در بدن ما درک کنند.
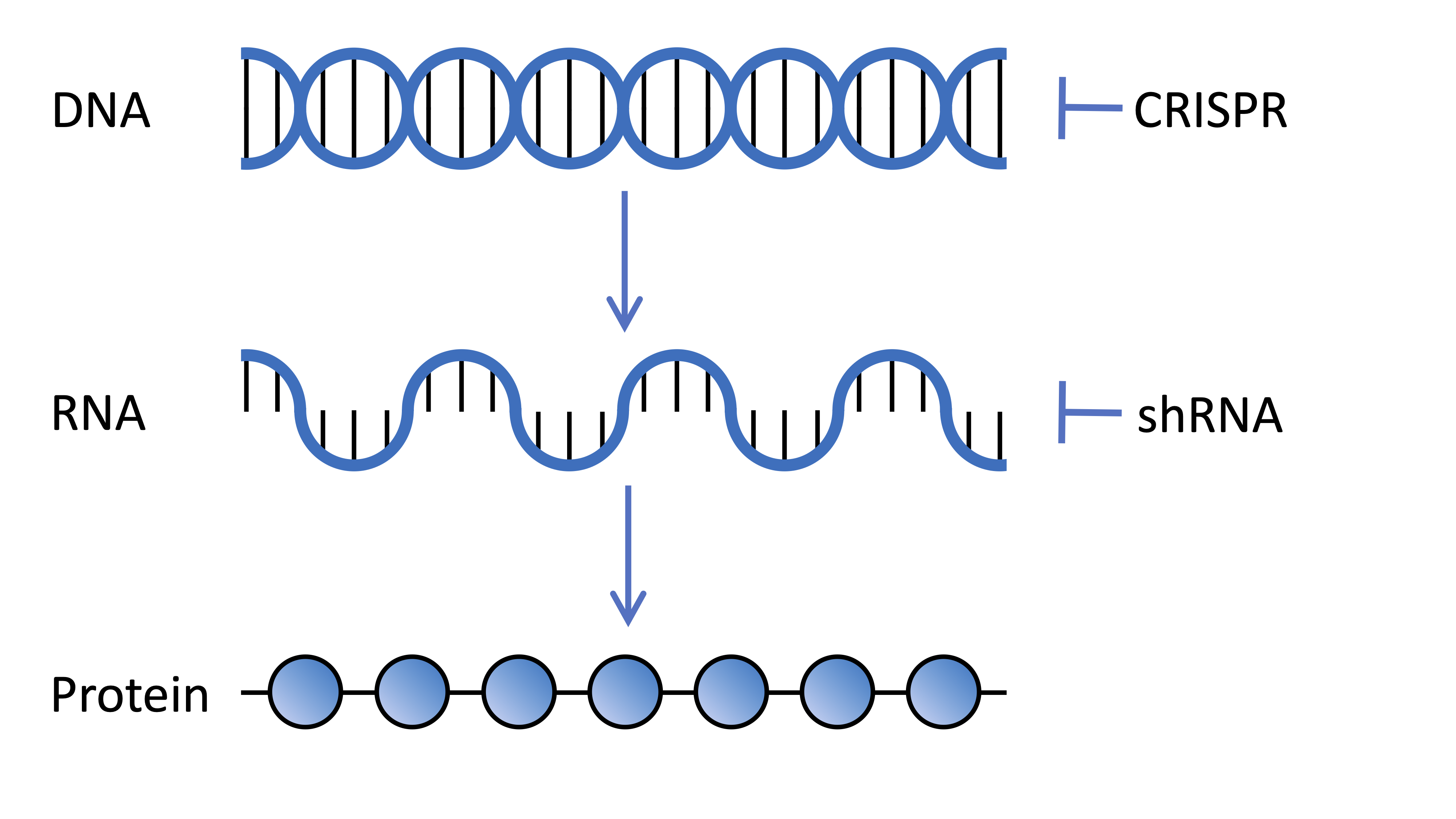
غربالگریهای ژنتیکی به دنبال درک نقش یک ژن واحد در زمینههای مختلف هستند، در این مورد، محققان علاقهمند بودند که نقش همه ژنهای مختلف در سلولهای ما در محافظت در برابر اثرات مخرب جهش HD چیست. بنابراین ایده این است که به نوبه خود با هر ژن منفرد بازی کنیم تا کشف کنیم که آیا آن ژن تأثیری بر علائم HD دارد یا خیر.
فناوریهای غربالگری ژنتیکی میتوانند به روشهای مختلفی کار کنند، اما هدف همه آنها متوقف کردن یا کاهش بیان پروتئینها از ژنهای خاص است. ژنها ممکن است مستقیماً با ویرایش خود ژنوم هدف قرار گیرند. سایر فناوریها در RNA پیامرسان که از ژن رونویسی میشود و برای سلولها ضروری است تا پروتئینی را که ژن رمزگذاری میکند، بسازند، تداخل ایجاد میکنند.
این ممکن است برای خوانندگان HDBuzz آشنا به نظر برسد، زیرا اینها فناوریهای مشابهی هستند که در درمانهای کاهش هانتینگتین استفاده میشوند که در حال حاضر در آزمایشهای بالینی مختلف ارزیابی میشوند. در حالی که این درمانهای کاهش هانتینگتین فقط ژن هانتینگتین را هدف قرار میدهند، در مورد این غربالگری ژنتیکی، محققان هر ژن را در ژنوم، یکی یکی، هدف قرار میدهند تا نقش آنها را در HD مشخص کنند.
موسسه Broad، جایی که پروفسور هایمن در آن مستقر است، یک رهبر جهانی در توسعه کتابخانههایی است که میتوان از آنها برای غربالگریهای ژنتیکی استفاده کرد. در این مطالعه، محققان از دو فناوری مختلف در غربالگری خود استفاده کردند که هر دو توسط انواع خاصی از ویروسها به سلولهای مغزی منتقل میشوند. اولاً، RNAهای کوتاه سنجاقسری که RNA پیامرسان را هدف قرار میدهند و با قطع پیام از ترجمه شدن به مولکول پروتئینی عملکردی، بیان ژن را کاهش میدهند. ثانیاً، CRISPR برای ویرایش مستقیم توالی ژن در ژنوم استفاده شد و توانایی آن را برای روشن شدن برای ساخت پروتئینی که رمزگذاری میکند، مختل کرد.
غربالگریهای ژنتیکی سیستماتیک در مدلهای حیوانی مختلف برای دههها برای سیستمهای سادهتری مانند کرمها و مگسها وجود داشته است. با این حال، انجام این نوع آزمایشها برای مغز پستانداران بسیار چالشبرانگیزتر بوده است که مانعی برای دانشمندان علاقهمند به انجام این غربالگریها برای درک بیماریهای مختلف عصبی تخریبکننده بوده است.
تیم پروفسور هایمن توانستند با یافتن راهی برای جمعآوری و متمرکز کردن معرفهایی که باید به مغز موشها در غربالگری ژنتیکی تزریق شوند، بر این مشکلات غلبه کنند و توانستند مستقیماً جسم مخطط را که ناحیهای از مغز است که به مطالعه آن علاقهمند بودند، هدف قرار دهند. جسم مخطط ناحیه مغزی است که بیشترین تأثیر را در بیماران HD دارد، به همین دلیل این ناحیه انتخاب شد.
بیش از 20000 ژن در این مطالعه مورد بررسی قرار گرفتند
دانشمندان در این مطالعه به جای بررسی ژنهای آشنای مرتبط با تخریب عصبی در مدلهای موشی خود، رویکردی بیطرفانه اتخاذ کردند و یک غربالگری در سطح ژنوم را برای بررسی نقش تقریباً هر ژن انجام دادند. در واقع، آنها تقریباً تمام حدود 22000 ژن موجود در موشها را غربال کردند! این یک رویکرد فوقالعاده جاهطلبانه بود و دادههای فراوانی را در اختیار محققان در زمینه HD و فراتر از آن قرار میدهد.
از آنجایی که این اولین غربالگری سیستماتیک از همه ژنها در سیستم عصبی مرکزی پستانداران بود، محققان از موشهای معمولی بدون جهشهای شناخته شده استفاده کردند تا مشخص کنند کدام ژنها در بقای سلولهای مغزی در شرایط عادی مهم هستند. نشان داده شد که ژنهایی که قبلاً در غربالگریهای سیستماتیک در مدلهای سادهتری مانند مگسها و کرمها شناسایی شده بودند، در موشها نیز مهم هستند.
با این حال، در این مطالعه، بسیاری از ژنهای جدید شناسایی شدند، از جمله چندین ژن که در متابولیسم در سلولها نقش دارند. اینها قبلاً در سایر غربالگریهای سیستماتیک در مگسها یا کرمها شناسایی نشده بودند، که احتمالاً به این دلیل است که سیستم عصبی مرکزی پستانداران به انرژی بیشتری نیاز دارد و بیشتر به ژنهایی وابسته است که به سلولها کمک میکنند انرژی تولید کنند. این یافتهها یادآوری خوبی از این است که چقدر مهم است که دانشمندان یافتههای تحقیقاتی خود را در زمینه مدلهای حیوانی مورد بررسی قرار دهند.

علاوه بر مدل موش کنترل، دو مدل موش HD مختلف در این آزمایش استفاده شد، R6/2 و zQ175، که هر دو به طور گسترده در مقالات تحقیقاتی HD شرح داده شدهاند. با مقایسه ژنهای شناسایی شده در غربالگری در مدلهای موش HD با ژنهای شناسایی شده در موشهای کنترل، دانشمندان میتوانند مشخص کنند که کدام ژنها به طور خاص برای HD مهم هستند، نه ژنهایی که به طور کلی بر عملکرد سلولهای مغزی تأثیر میگذارند.
برای غربالگریهای ژنتیکی انجام شده بر روی دو مدل موش HD مورد استفاده در این مطالعه، تقریباً 500 ژن به عنوان مهم در پیشرفت HD شناسایی شدند. بسیاری از این ژنها در مسیرهایی نقش دارند که دانشمندان قبلاً در مطالعات دیگر شناسایی کردهاند، مانند مطالعات ارتباط گسترده ژنومی (GWAS) که به دنبال ژنهایی بودند که میتوانند سن شروع علائم HD را در بیماران انسانی تغییر دهند. اینها شامل ژنهای درگیر در مسیرهای ترمیم آسیب DNA است که یکپارچگی مواد ژنتیکی ما را حفظ میکنند و همچنین ژنهای موجود در مسیرهای رونویسی که نحوه پردازش RNA پیامرسان را در سلولها تنظیم میکنند و بنابراین کدام مولکولهای پروتئینی ساخته میشوند.
اهداف ژنی جدید نیز در غربالگری شناسایی شدند، از جمله ژنهای متعلق به خانواده Nme. قبلاً گزارش شده بود که ژنهای Nme با گسترش در برخی سرطانها مرتبط هستند، اما این اولین بار است که آنها به HD مرتبط میشوند. هایمن و همکارانش فکر میکنند که هدف قرار دادن مسیر Nme ممکن است در کمک به سلولهای مغزی برای خلاص شدن از شر پروتئین هانتینگتین جهشیافته در مغزهای HD مهم باشد. اگر بتوانیم درمانهایی را طراحی کنیم که این مسیر را تعدیل کنند، این میتواند راهی بالقوه برای کمک به درمان HD باشد.
سرنخهای جدید برای ساخت داروهای جدید HD
حتی با وجود آزمایشهای بالینی پیشگامانه زیادی که در حال انجام است و درمانهای مختلفی را برای بیماران HD آزمایش میکند، مهم است که محققان به دنبال راههای جایگزین برای ساخت داروهای جدید برای HD باشند. این تحقیق دادههای فراوانی را در مورد HD ارائه میدهد، زیرا در مغز مدل موش کار میکند و همچنین به ما ایدههایی از اهداف جدید برای پیگیری به عنوان اهداف دارویی بالقوه میدهد، که ممکن است روزی در خط لوله کشف دارو قرار گیرند. هیجانانگیز خواهد بود که ببینیم این سرنخهای جدید چگونه توسط محققان در سراسر جهان پیگیری میشوند و همچنین چگونه این فناوری ممکن است در سایر بیماریهای عصبی تخریبکننده به کار گرفته شود.
بیشتر بدانید
برای اطلاعات بیشتر در مورد سیاست افشای اطلاعات ما، به سوالات متداول مراجعه کنید…


