موفقیت دوگانه برای خاموشسازی ژن RNAi هانتینگتین
دو خبر خوب برای خاموشسازی ژن RNAi در بیماری HD: این روش در طی شش ماه بیخطر است و راهی برای درمان مناطق بزرگتری از مغز وجود دارد

احتیاط: ترجمه خودکار – احتمال خطا
برای انتشار اخبار تحقیقات HD و بهروزرسانیهای آزمایشی در اسرع وقت به حداکثر تعداد افراد، این مقاله به طور خودکار توسط هوش مصنوعی ترجمه شده و هنوز توسط ویراستار انسانی بررسی نشده است. در حالی که ما تلاش میکنیم اطلاعات دقیق و قابل دسترس ارائه دهیم، ترجمههای هوش مصنوعی ممکن است حاوی خطاهای دستوری، تفسیرهای نادرست یا عبارات نامفهوم باشند.برای اطلاعات موثقتر، لطفاً به نسخه اصلی انگلیسی مراجعه کنید یا بعداً برای ترجمه کاملاً ویرایششده توسط انسان دوباره مراجعه کنید. اگر متوجه مشکلات قابل توجهی شدید یا اگر زبان مادری شما این زبان است و میخواهید در بهبود ترجمههای دقیق کمک کنید، لطفاً با editors@hdbuzz.net تماس بگیرید.
اکثر محققان HD از ایده «خاموش کردن» ژن بیماری هانتینگتون برای کاهش تولید پروتئین هانتینگتین مضر بسیار هیجانزده هستند. دو چالش – ایمنی و انتقال – اکنون به لطف همکاری محققان دانشگاهی و صنعتی به حل شدن نزدیکتر شدهاند.
ما از طرفداران بزرگ خاموشسازی ژن هستیم. مانند بسیاری از محققان بیماری هانتینگتون، ما فکر میکنیم این رویکرد به احتمال زیاد یک درمان مؤثر برای HD ایجاد میکند.
خاموشسازی ژن شامل استفاده از دارویی است که بهطور ویژه طراحی شده است تا یک مولکول پیامرسان به نام RNA را که از ژن HD تولید میشود و به سلولها میگوید پروتئین هانتینگتین مضر را بسازند، رهگیری کند. اثر دارو این است که سلولها پروتئین کمتری تولید میکنند.
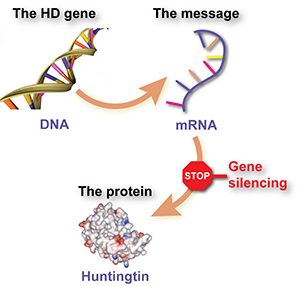
به زبان سادهتر، خاموشسازی ژن مانند یک علامت ایست برای هانتینگتین جهشیافته است.
پیشرفت سریع
تا کنون، خاموشسازی ژن برای HD، در اشکال مختلف، از هر مانعی که با آن مواجه شده، عبور کرده است. اکنون در چندین مدل موش و موش صحرایی HD آزمایش شده است و نه تنها پیشرفت را کند کرده، بلکه در واقع باعث بهبود علائم و آسیب مغزی نیز شده است. به نظر میرسد که مغز در واقع میتواند تا حدی بهبود یابد، اگر فقط سطح پروتئین مضر کمی کاهش یابد.
موانع باقیمانده
چندین تیم تحقیقاتی در حال حرکت به سمت آزمایشهای انسانی خاموشسازی ژن در HD هستند. اما قبل از آن، چند چالش باقیمانده وجود دارد که باید به آنها رسیدگی شود.
اولین مورد ایمنی است. عوارض جانبی غیرمنتظره همیشه ممکن است و میتواند چشمگیر باشد، زیرا ما در مورد داروهایی صحبت میکنیم که مستقیماً به سیستم عصبی تزریق یا انفوزیون میشوند و مستقیماً با ماشین آلات ژنتیکی سلولهای ما تعامل دارند.
مورد دیگر انتقال است. داروهای خاموشسازی ژن را نمیتوان به صورت قرص یا تزریق به خون تجویز کرد، زیرا به مغز راه پیدا نمیکنند. بنابراین باید مستقیماً وارد سیستم عصبی شوند. بسته به ساختار دارو، این به معنای عمل جراحی برای وارد کردن سوزن یا لوله به ستون فقرات یا جمجمه است. این کارها شدید به نظر میرسند، اما اگر درمان مؤثر باشد، ارزشش را خواهد داشت.
با این حال، مشکل انتقال در اینجا متوقف نمیشود، زیرا هنگامی که دارو در سر قرار گرفت، باید برای انجام جادوی ژنتیکی خود به داخل سلولهای مغزی ما برسد.
منوی خاموشسازی ژن
محققان خاموشسازی ژن باید قبل از شروع یک آزمایش درمانی، چندین انتخاب انجام دهند. در اینجا یک چک لیست وجود دارد تا به شما در درک اخبار آینده کمک کند.
اول، ما باید در مورد ساختار دارو تصمیم بگیریم. دو انتخاب اساسی وجود دارد: داروهای RNAi که از نظر شیمیایی شبیه به مولکولهای پیامرسان RNA بدن هستند. و داروهای ASO که کمی متفاوت هستند اما ممکن است بهتر توسط سلولها جذب شوند.
انتخاب دوم این است که چه هدفی را انتخاب کنیم: هر دو نسخه ژن HD یا فقط نسخه جهشیافته. هدف قرار دادن هر دو – که خاموشسازی غیر اختصاصی نامیده میشود – آسانتر است، اما خاموش کردن ژن «طبیعی» ممکن است خطرناک باشد. هدف قرار دادن فقط ژن جهشیافته – که خاموشسازی ویژه آلل نامیده میشود – ممکن است ایمنتر باشد اما انجام آن بسیار دشوارتر است.
انتخاب سوم مقصد است – دارو به کجا خواهد رفت؟ داروهای RNAi به طور طبیعی زیاد پخش نمیشوند، بنابراین دارو باید مستقیماً به ماده مغز تحویل داده شود. داروهایی که بیشتر پخش میشوند، مانند ASOها، میتوانند به مایع اطراف مغز یا اگر خوش شانس باشیم، در قاعده ستون فقرات تزریق شوند.
چهارم، ما باید در مورد انتقال تصمیم بگیریم. آیا دارو به تنهایی داده میشود، در یک ویروس بستهبندی میشود یا با فشار پمپ میشود تا گسترش آن در مغز افزایش یابد؟
انتخاب پنجم رژیم درمانی است. آیا باید یک درمان یکباره انجام دهیم یا دارو را طی هفتهها یا ماهها تزریق کنیم؟ در حال حاضر نمیدانیم اثرات چه مدت طول میکشد، بنابراین این باید با مقایسه رژیمهای مختلف مشخص شود.
هر زمان که در مورد تحقیقات خاموشسازی ژن میخوانید، کمک میکند که از قبل مشخص کنید کدام گزینه برای هر یک از این انتخابها انتخاب شده است.
سه مورد به طور همزمان میآیند
در کنگره جهانی HD اخیر در ملبورن، HDBuzz گزارشهایی از ارائههای هیجانانگیز از چندین گروه تحقیقاتی خاموشسازی ژن ارائه داد. سپس در ماه نوامبر، ما اخباری از اولین آزمایش ایمنی خاموشسازی ژن هانتینگتین با استفاده از RNAi در مغز یک نخستی را برای شما آوردیم.
«داروی RNAi بیشتر از آنچه که با تزریقهای ساده به دست میآورید، پخش میشود. در واقع خیلی بیشتر.»
اکنون، دو مقاله علمی دیگر منتشر شده است – که هر کدام ثمره همکاری بین محققان دانشگاهی و شرکتهای بیوتکنولوژی است. هر دو مقاله شامل شرکت Medtronic مستقر در مینیاپولیس و تیم دکتر ژمینگ ژانگ در دانشگاه کنتاکی بود.
ایمنی شش ماهه
گزارش نوامبر در مورد ایمنی RNAi در نخستیها یک مطالعه نسبتاً کوتاه بود – شش هفته. مطالعه جدید توسط Medtronic و تیم ژانگ، که در مجله Brain گزارش شده است، نیز در میمونهای رزوس انجام شد، اما شش ماه کامل به طول انجامید.
بیایید با استفاده از چک لیست بالا، به بررسی آنچه محققان مطالعه کردهاند بپردازیم:
-
ساختار: این یک آزمایش داروی RNAi بود.
-
هدف: هر دو نسخه ژن هدف قرار گرفتند – کاهش غیر اختصاصی.
-
مقصد: ماده مغز – جسم مخطط، به طور دقیق، که در بیماران HD زودتر تحت تأثیر قرار میگیرد.
-
انتقال: دارو در یک ویروس خالی به نام AAV2 بستهبندی شده بود.
-
رژیم درمانی: یک تزریق یکباره به پنج محل در هر طرف مغز
همچنین شایان ذکر است که از میمونهای «طبیعی» بدون نسخههای گسترش یافته ژن HD استفاده شده است. بنابراین، این آزمایش فقط میتواند تغییرات پروتئین و ایمنی را اندازهگیری کند – نمیتواند بهبود در بیماران را پیشبینی کند.
پس از درمان، میمونها به مدت شش ماه تحت نظر قرار گرفتند و سلامت عمومی و کنترل حرکتی آنها بررسی شد. عمل جراحی به خوبی تحمل شد و هیچ مشکل جدیدی در حیوانات تحت درمان مشاهده نشد.
همانطور که امید میرفت، سطح پروتئین هانتینگتین به طور قابل توجهی در مناطق تحت درمان کاهش یافت. در هر محل تزریق، سطح پروتئین در ناحیهای به وسعت حدود شش میلیمتر کاهش یافت – از نظر حجم، این حدود سه عدد M&M به ازای هر مغز است. ممکن است زیاد به نظر نرسد، اما در مغز انسان میتواند تفاوت بزرگی ایجاد کند، و به یاد داشته باشید که این اندازهگیریها 6 ماه پس از درمان یکباره انجام شده است.
خوشبختانه، دارو هیچ تغییر مضر مغزی مانند التهاب، عفونت یا آسیب عصبی ایجاد نکرد.
بنابراین، دارو کار خود را در کاهش سطح پروتئین انجام داد و به نظر نمیرسید که درمان هیچ اثر مضری ایجاد کند. نویسندگان تخمین میزنند که شش ماه میمون معادل حدود 18 ماه انسان است. خوب به نظر میرسد – اما همانطور که نویسندگان اشاره میکنند، ممکن است حتی بیشتر طول بکشد تا اثرات خوب یا بد در انسان ظاهر شود.
یک روش انتقال نوآورانه
مقاله جدید دیگر از یک همکاری سه جانبه بین تیم دانشگاه کنتاکی، Medtronic و شرکت دارویی RNAi Alnylam Pharmaceuticals حاصل شد. این مقاله در مجله Experimental Neurology منتشر شد.
این نیز یک مطالعه در مورد RNAi کاهش غیر اختصاصی بود که به جسم مخطط میمونها تحویل داده شد.
آنچه این کار را متمایز میکند، روش انتقال نوآورانه است. از تکنیکی به نام انتقال تقویتشده با همرفت (CED) استفاده شد. این شامل قرار دادن لولهها از طریق جمجمه و به داخل ماده مغز است. انتهای بالایی لوله به یک پمپ کوچک متصل است که به طور مداوم دارو را با فشار به پایین لوله میپاشد. این فشار کلیدی است – باعث میشود مولکول دارو بسیار بیشتر از آنچه در غیر این صورت پخش میشد، گسترش یابد.

CED در حال حاضر برای رساندن داروهای شیمیدرمانی به منظور گسترش بیشتر در داخل تومورهای مغزی استفاده میشود. اما آیا برای رساندن یک داروی RNAi کارساز خواهد بود؟
ابتدا دارو به مدت هفت روز به مغز پمپ شد. فقط یک طرف مغز تحت درمان قرار گرفت تا از طرف دیگر برای مقایسه استفاده شود. از طیف وسیعی از دوزها و سرعتهای تزریق استفاده شد تا بهترین ترکیب پیدا شود. سپس، یک تزریق 28 روزه امتحان شد. به طور هوشمندانه، تیم تغییرات رادیواکتیو بیضرری را در دارو ایجاد کرد که به آنها امکان داد دقیقاً میزان گسترش آن را اندازهگیری کنند.
دارو کار خود را در کاهش سطح هانتینگتین انجام داد و لولهها و تزریقها به طور خاص به مغز آسیب نرساندند.
اما آیا دردسر اضافی نصب لولهها و پمپها ارزشش را داشت – آیا دارو بیشتر پخش شد؟ به طور خلاصه، بله.
اندازهگیریها نشان داد که داروی RNAi بسیار بیشتر از آنچه که با تزریقهای ساده انتظار میرود، گسترش یافته است. اگر هر دو طرف مغز تحت درمان قرار میگرفتند، سطح هانتینگتین در حدود یازده عدد M&M کاهش مییافت.
به طور خلاصه…
قبل از انتشار این دو مقاله، ما از قبل میدانستیم که میتوان با استفاده از RNAi سطح هانتینگتین را در مغز میمون کاهش داد. اکنون میتوانیم دو علامت اصلی را به لیست آرزوهای خود اضافه کنیم: اول، خاموشسازی در دورههای طولانیتر کار میکند و بیخطر است، و دوم، راههایی برای گسترش بیشتر دارو وجود دارد.
چه چیزی میتواند اشتباه پیش برود؟
خوشبینی محتاطانه در اینجا یک رویکرد عاقلانه است. مطمئناً برخی از مواردی وجود دارد که میتواند در مسیر آزمایشهای انسانی یا در طول آنها اشتباه پیش برود.
این آزمایشهای نخستیها نشان داده است که کاهش سطح هانتینگتین در میمونهای سالم بیخطر است. اما این بدان معنا نیست که قطعاً در بیماران انسانی بیخطر است. مغز انسان بسیار بزرگتر و پیچیدهتر از مغز میمون است. بنابراین درمان میتواند به سادگی به دلیل تفاوت گونهها کمتر مؤثر یا خطرناکتر باشد.
همچنین این احتمال وجود دارد که پروتئین سالم به نوعی از مغز در برابر برادر مضر خود در انسان محافظت کند. اگر اینطور باشد، خاموش کردن هر دو نسخه میتواند به طور غیرمنتظرهای بیشتر از فایده ضرر داشته باشد.
مغز افراد مبتلا به علائم HD احتمالاً شکنندهتر است و عمل جراحی روی آن دشوارتر است. قسمتهایی از مغز که نیاز به درمان دارند به دلیل کوچک شدن ناشی از HD کوچکتر از حد معمول هستند. بنابراین عملها ممکن است سختتر و پرخطرتر باشند.
در نهایت، تشخیص موفقیت ممکن است در انسان دشوار باشد، زیرا بیماری به آرامی پیشرفت میکند و ما نمیتوانیم مغز بیماران را زیر میکروسکوپ بررسی کنیم.
اما هرگز فراموش نکنید – همه این مشکلات به طور مشترک توسط برخی از بهترین ذهنهای علمی جهان در حال بررسی است، همه بر این تمرکز دارند که درمانهای مؤثر را برای بیماران به واقعیت تبدیل کنند.
2012 – سال خاموشسازی ژن برای HD؟
آیا 2012 میتواند سال خاموشسازی ژن برای بیماران HD باشد؟ آیا در ماههای آینده شاهد یک یا چند آزمایش انسانی خواهیم بود؟ با توجه به پیشرفتهای تا کنونی، ما در واقع معتقدیم که این یک چیز منطقی برای امیدواری است و چندین گروه سخت در تلاش هستند تا آن را به واقعیت تبدیل کنند. اولین آزمایشها کوچک خواهند بود و به آرامی و با احتیاط فراوان انجام میشوند، زیرا ایمنی دغدغه اصلی است. اما اگر همه چیز خوب پیش برود، آزمایشهای بزرگتری به دنبال خواهند داشت.
بیشتر بدانید
- مقاله Brain در مورد درمان 6 ماهه RNAi توسط گروندین و همکاران (دسترسی آزاد)
- مقاله Experimental Neurology در مورد انتقال RNAi با استفاده از روش انتقال تقویتشده با همرفت توسط استایلز و همکاران (نسخه کامل مقاله نیازمند پرداخت هزینه یا اشتراک است)
- مقاله ما در مورد آزمایش ایمنی قبلی روی نخستیها توسط دکتر بورلی دیویدسون
منابع و مراجع
برای اطلاعات بیشتر در مورد سیاست افشای اطلاعات ما، به سوالات متداول مراجعه کنید…